El concepto de estándares de etiquetado médico subraya que el funcionamiento seguro de un dispositivo médico nunca debe depender de conjeturas o prueba y error.
Estos estándares garantizan que el etiquetado informativo y preciso no sea solo una opción sino una necesidad, y cada etiqueta que acompaña al dispositivo debe cumplir con los estándares y regulaciones pertinentes.
Cuando las características o los peligros no están etiquetados adecuadamente, la puerta se abre para un mal uso, lo que puede causar daño al usuario y erosionar la confianza en la confiabilidad del dispositivo. El etiquetado adecuado es fundamental para prevenir errores y garantizar que los usuarios obtengan de forma segura los beneficios previstos del dispositivo.
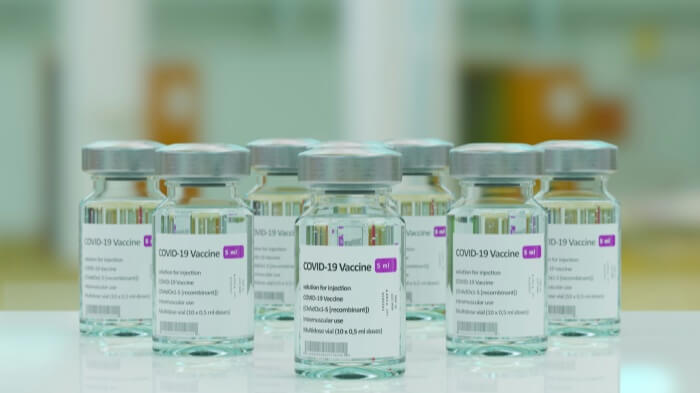
El etiquetado trasciende de ser una mera formalidad en el proceso productivo de los fabricantes de dispositivos médicos; es indispensable. Sin las etiquetas necesarias, los dispositivos no pueden lanzarse al mercado.
Las regulaciones rigen todos los aspectos del etiquetado, desde el diseño de las etiquetas hasta los métodos utilizados para fijarlas a un dispositivo, lo que requiere que los fabricantes le den al etiquetado el mismo nivel de importancia que a cualquier otra faceta del aseguramiento de la calidad del producto.
Esta discusión tiene como objetivo aclarar qué constituye una etiqueta de dispositivo médico, delinear dónde dicho etiquetado es imperativo y profundizar en los aspectos críticos de las regulaciones de etiquetado de dispositivos médicos tanto en los Estados Unidos como en la Unión Europea.
Después de esta exploración, ofreceremos pautas generales diseñadas para ayudar a los fabricantes a elaborar etiquetas que no solo beneficien a sus clientes sino que también cumplan con los requisitos reglamentarios, garantizando que sus dispositivos se utilicen de manera segura y efectiva.
¿Qué se considera exactamente un dispositivo médico en términos legales?
Legalmente, la definición de la FDA abarca cualquier artículo que se utilice para diagnosticar, curar, tratar, o prevenir enfermedades o condiciones de salud, o que altere significativamente la estructura o función del cuerpo. Esta amplia categoría incluye diversas formas de instrumentos, aparatos, máquinas, implantes o reactivos in vitro, así como cualquier pieza, componente o accesorio relacionado con estos dispositivos.
Notably, substances that are metabolized by the body, such as drugs, do not fall under the “device” category. Interestingly, software also enters the realm of medical devices if it directly contributes to any of the aforementioned functions, though software merely used for storing data or administrative purposes is excluded.
De manera similar, el Reglamento de Dispositivos Médicos de la Unión Europea identifica los dispositivos médicos como productos no farmacológicos que están diseñados para diagnosticar, curar y/o prevenir afecciones y enfermedades médicas. Estos dispositivos también pueden usarse para investigar procesos anatómicos, fisiológicos o patológicos. con el propósito de reemplazo y/o modificación, o para recolectar y conservar muestras de pacientes humanos para análisis médicos.
La pregunta de qué parte dentro de la cadena de suministro de un dispositivo es responsable de su etiquetado puede no siempre presentar una respuesta clara. Normalmente, la responsabilidad recae en el fabricante del dispositivo, sin embargo, hay casos en los que otras partes involucradas también podrían asumir las tareas de etiquetado. Esta lista se puede ampliar para incluir:
- Reprocesadores de dispositivos utilizados anteriormente,
- Reenvasadores de dispositivos,
- Entidades que reetiquetan dispositivos,
- Los ensambladores de kits compilan varios componentes del dispositivo,
- Los desarrolladores de especificaciones proporcionan descripciones detalladas de los dispositivos,
- E incluso los fabricantes que no están seguros de sus obligaciones específicas de etiquetado.
Para los fabricantes que se enfrentan a incertidumbres con respecto a sus responsabilidades de etiquetado, es recomendable consultar las directrices emitidas por su organismo regulador regulador.. Este paso garantiza el cumplimiento y fomenta una comprensión más clara de sus funciones en la salvaguardia de la seguridad del consumidor a través del etiquetado adecuado de los dispositivos..
¿Qué deben saber los fabricantes sobre las normas de etiquetado de dispositivos médicos?
Tanto en los Estados Unidos como en la Unión Europea, las estipulaciones para el etiquetado de dispositivos médicos son meticulosamente detalladas y completas, y a menudo se adaptan a la categoría específica del dispositivo.
Es imperativo que los fabricantes consulten directamente la redacción exacta de los estatutos y regulaciones relevantes, asegurando que sus prácticas se alineen exactamente con los requisitos legales y mantengan el cumplimiento.
Esta diligencia es crucial no sólo para el cumplimiento de las normas legales sino también para la seguridad y el uso informado de los dispositivos médicos por parte de los profesionales sanitarios y los pacientes por igual.
El mandato de la FDA de EE. UU. para las etiquetas de dispositivos médicos
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) define una etiqueta como cualquier “exhibición de material escrito, impreso o gráfico en el contenedor inmediato de cualquier artículo”, lo que requiere una visibilidad clara incluso cuando el “contenedor inmediato” está aún más cerrado.
El término “etiqueta” abarca además cualquier material impreso en el envase o envoltorio de un producto, o cualquier artículo que acompañe al producto en el punto de venta. A través de esta amplia definición, Los tribunales estadounidenses han determinado que la publicidad, los carteles, los folletos, los manuales de instrucciones, los encartes y cualquier material análogo también se clasifican como etiquetas para la supervisión regulatoria.
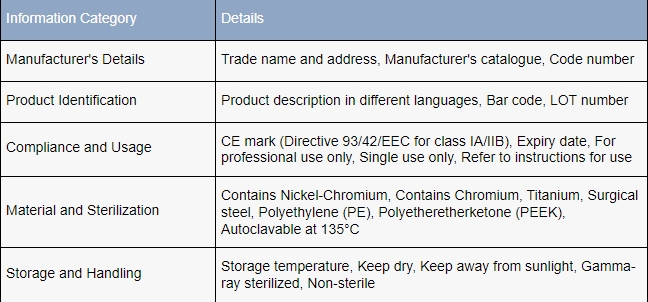
Los requisitos de etiquetado específicos se enumeran en el Título 21 del CFR, Parte 801, que dicta que las etiquetas que cumplen con la FDA deben incluir:
- El nombre y la dirección comercial del fabricante.
- La aplicación prevista del dispositivo,
- Instrucciones completas que permiten a un profano utilizar el dispositivo de forma segura sin asistencia profesional.
Las etiquetas deben evitar cualquier afirmación falsa o engañosa y colocarse de manera visible en un lugar adecuado del embalaje.
Además, la FDA obliga a los fabricantes a incorporar etiquetas de identificación única de dispositivo (UDI) para facilitar el seguimiento preciso de los dispositivos.. Estos UDI deben ser legibles tanto para humanos como para máquinas, lo que garantiza que los elementos de seguimiento cumplan con estándares rigurosos de claridad y accesibilidad.

Las disposiciones para el etiquetado según el MDR de la UE
El Reglamento de Dispositivos Médicos (MDR) de la Unión Europea abarca sus regulaciones de etiquetado dentro del Anexo I, Capítulo III. Estas regulaciones se corresponden en términos generales con las de la FDA, incluido el mandato de Identificación Única de Dispositivo (UDI) en las etiquetas.
Más allá de colocar etiquetas directamente en el dispositivo médico o en su embalaje, cuando corresponda, Los fabricantes de la UE también están obligados a proporcionar información de etiquetado actualizada a través de su sitio web corporativo. Este requisito garantiza la transparencia y accesibilidad de la información, lo que permite a los usuarios finales y a los organismos reguladores acceder y revisar fácilmente los detalles del etiquetado pertinentes a los dispositivos médicos..
¿Por qué se debe dar suma importancia al etiquetado de los dispositivos médicos?
El etiquetado claro y preciso en los dispositivos médicos tiene una importancia fundamental, especialmente porque muchos de estos dispositivos están destinados a ser utilizados por pacientes en casa, sin la supervisión de profesionales sanitarios.
Para garantizar la seguridad y eficacia, no sólo los pacientes sino también los profesionales médicos y los usuarios experimentados dependen en gran medida de instrucciones lúcidas, orientación y detalles de advertencia.
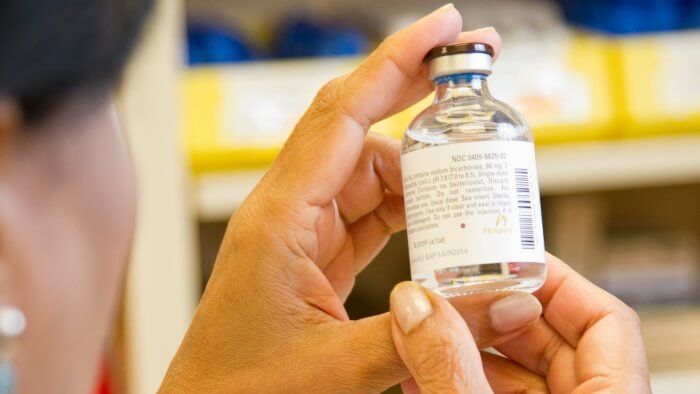
En casos de mal uso o manejo incorrecto, las repercusiones para el usuario pueden variar desde el mal funcionamiento del dispositivo hasta lesiones graves o incluso la muerte.. Incluso pequeños pasos en falso pueden tener efectos adversos en los resultados de salud del paciente.
Para todas las partes involucradas en el ciclo de vida del dispositivo (desde el diseño hasta la entrega), el bienestar del usuario final debe ser la máxima prioridad.
Las buenas prácticas de etiquetado sirven como una herramienta vital para reducir los incidentes adversos y mantener la confianza en los dispositivos médicos. Además, estas prácticas no tienen como único objetivo salvaguardar la salud del usuario; también tienen que ver con el cumplimiento de los estándares regulatorios.
Un etiquetado eficaz puede evitar los contratiempos del incumplimiento, como costosos retrasos, retiradas del mercado o problemas legales, garantizando así la entrega ininterrumpida de dispositivos médicos al mercado.
Los principios clave para la elaboración de etiquetas para dispositivos médicos
Crear una etiqueta de dispositivo médico ejemplar no es la búsqueda de una plantilla universal sino un proceso matizado. Los elementos cruciales varían significativamente en función de una multitud de factores, siendo los fabricantes la responsabilidad de garantizar la inclusión de todos los componentes vitales.
El objetivo de una etiqueta no es sólo cumplir los mandatos reglamentarios, sino también garantizar que imparta toda la información necesaria para que el paciente obtenga un resultado positivo del uso del dispositivo.
Para lograr tal objetivo, aquí hay un resumen ampliado de las mejores prácticas para el desarrollo de etiquetas efectivas y conformes:
- Iniciar consideraciones de diseño de etiquetas en las primeras etapas del desarrollo del producto, para integrar el etiquetado perfectamente con el diseño y la función del dispositivo.
- Consulte diligentemente las pautas específicas establecidas por su organismo regulador para determinar el alcance completo de la información que debe incluirse, particularmente dentro de las instrucciones de uso.
- Emplear símbolos estandarizados que cumplan con las regulaciones internacionales para garantizar la comprensión y el uso universal.
- Opte por materiales de etiquetas resistentes capaces de soportar procesos repetidos de limpieza y esterilización manteniendo la legibilidad.
- Optimice la producción de etiquetas mediante la automatización para mejorar la coherencia y reducir la probabilidad de error humano.
- Cree plantillas de etiquetas adaptables que se actualicen fácilmente con la información necesaria para acelerar el proceso de etiquetado de varios productos.
- Colaborar estrechamente con los socios de la cadena de suministro para sincronizar los esfuerzos de cumplimiento y evitar tareas de etiquetado redundantes.
- Realice pruebas de usabilidad exhaustivas para confirmar que los usuarios interpretan y comprenden con precisión el mensaje previsto de sus etiquetas.
- Incorporar advertencias integrales que detallen todos los riesgos conocidos y establezcan claramente las implicaciones del uso no indicado en la etiqueta.
- Antes de solidificar su enfoque de etiquetado, realice una revisión exhaustiva del marco legal para determinar cualquier requisito de etiquetado adicional y especializado relevante para sus dispositivos médicos específicos.. Este paso garantiza que sus etiquetas no solo sean informativas sino que también cumplan con la ley, alineándose con las regulaciones y estándares.
QMS y etiquetado de dispositivos médicos
Un sistema de gestión de calidad (SGC) meticulosamente adaptado a las demandas únicas de los fabricantes de dispositivos médicos sirve como columna vertebral esencial.e, garantizando el cumplimiento de los requisitos reglamentarios y apoyando la producción de etiquetas que reflejen la alta calidad de los dispositivos que acompañan.
Una solución QMS efectiva reforzará los protocolos de etiquetado al mantener los datos de fabricación actualizados, realizar un seguimiento meticuloso de las revisiones de los documentos y verificar que cada aspecto del proceso de etiquetado cumpla estrictamente con todas las regulaciones pertinentes.
Además, la implementación de un sistema de gestión de la calidad es fundamental para crear un enfoque estandarizado para el etiquetado, donde la coherencia en la calidad de la etiqueta se vuelve tan crítica como la calidad del dispositivo.. El sistema ayuda a identificar posibles no conformidades antes de que se conviertan en problemas, mejorando la eficiencia operativa general.
Al incorporar un SGC sólido, los fabricantes pueden estar seguros de que sus etiquetas son precisas, están actualizadas y están totalmente alineadas con los estándares establecidos por la industria, fortaleciendo así la confianza y la seguridad de los proveedores de atención médica y de los pacientes por igual.
Posibles direcciones futuras para el etiquetado de dispositivos médicos
A medida que avanza la tecnología y evolucionan las demandas de la industria de la salud, el futuro del etiquetado de dispositivos médicos se centrará más en las tecnologías inteligentes, la personalización y la sostenibilidad ambiental. Estas son algunas tendencias anticipadas:
- Integración de tecnologías de etiquetas inteligentes: Las futuras etiquetas de dispositivos médicos pueden incorporar tecnologías avanzadas como NFC (comunicación de campo cercano), RFID (identificación por radiofrecuencia) y sensores. Estas tecnologías podrían permitir el seguimiento en tiempo real del uso y la ubicación del dispositivo, mejorando la eficiencia y precisión de la gestión de dispositivos.
- Mayor personalización y personalización.: Con los avances en las tecnologías de impresión, como la impresión 3D, las etiquetas de los dispositivos médicos podrían alcanzar niveles más altos de personalización y adaptación. Los proveedores de atención médica podrían adaptar el contenido de las etiquetas para satisfacer necesidades clínicas específicas, atendiendo mejor tanto a los pacientes como a los profesionales médicos.
- Uso de materiales ecológicos.: En respuesta a las crecientes preocupaciones medioambientales, es probable que las etiquetas futuras utilicen materiales reciclables o biodegradables, reduciendo el impacto medioambiental y alineándose con los esfuerzos globales de sostenibilidad.
- Información completa sobre cumplimiento normativo y seguridad: A medida que las regulaciones internacionales se vuelven más estrictas, las etiquetas de los dispositivos médicos deberán incluir instrucciones de seguridad y declaraciones de cumplimiento más detalladas. Esto ayudará a los proveedores de atención médica a comprender y utilizar mejor los dispositivos y, al mismo tiempo, garantizar la seguridad del paciente.
- Interacción mejorada con el paciente: Las etiquetas pueden incluir elementos interactivos como códigos QR que enlazan con videos instructivos, manuales de usuario y otros recursos educativos para el paciente.. Esta interacción puede alentar a los pacientes a asumir un papel activo en su tratamiento, mejorando la adherencia y los resultados.
Conclusión
En resumen, el cumplimiento de estándares de etiquetado médico es esencial para salvaguardar la seguridad del paciente y mantener la confianza en los dispositivos médicos, y las máquinas etiquetadoras desempeñan un papel central en esto.
Somos una empresa que fabrica máquinas etiquetadoras de productos farmacéuticos versátiles diseñadas para cumplir con estos estándares para una amplia gama de aplicaciones de dispositivos médicos, incluidas viales, jeringas, y ampollas. Para los fabricantes que buscan confiabilidad y cumplimiento en el proceso de etiquetado, ¡somos su socio confiable!
